Является ли приобретение устойчивости к антибиотикам и пестицидам доказательством эволюции?
Автор: Джерри Бергман (англ. Jerry Bergman)
Перевод: Алена Недоступ
Источник: creation.com
Редактура: Елена Бондаренко, Данил Волгожанин
Развитие устойчивости к антибиотикам и пестицидам часто преподносится как современный пример эволюции путем мутаций и как явное доказательство дарвинизма. Обзор литературы показал, что большинство примеров приобретения устойчивости не являются результатом мутаций, но почти во всех случаях являются результатом сложных генетических и молекулярно-биологических защитных систем. В существующей на данный момент литературе указывается, что те немногие примеры, которые обусловлены именно мутациями, во всех случаях обусловлены мутациями потери и не приводят к приобретению генетической информации.
——————————————————————————
Одним из наиболее распространенных аргументов против сотворения является хорошо задокументированное развитие устойчивости бактерий к антибиотикам и насекомых к инсектицидам. Типичный пример можно найти в книге The Evolution Explosion гарвардского биолога Стивена Палумби (Stephen Palumbi). В этой работе, согласно недавнему обзору, Палумби подробно обсуждает
«…случаи, когда люди стали причиной быстрой эволюции у других видов, изменяя их среду обитания: среди его примеров, можно найти эволюцию устойчивости бактерий к антибиотикам, растений к гербицидам, насекомых к пестицидам и изменения скорости роста рыб, вызванные чрезмерным отловом рыбы. Примечательно, что многие люди, знакомые с этими явлениями, не смогли увидеть, что они демонстрируют эволюцию, движимую отбором. Существует, например, общественное заблуждение, что «лекарственная устойчивость» предполагает не эволюционное изменение патогенных бактерий, а некий процесс, в результате которого человек акклиматизируется к антибиотикам».[1]
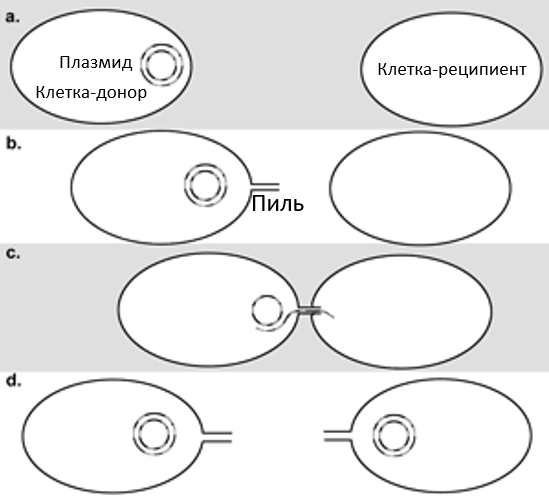
Рисунок 1. а) донорская клетка содержит плазмиду, известную как фактор резистентности или R-фактор (R), которая передает устойчивость к антибиотику X. b) клетка-донор образует трубчатую структуру – пиль, соединяющийся с клеткой-реципиентом. с) одна из двух нитей ДНК R-фактора передается от клетки-донора к клетке-реципиенту через пиль. d) каждая клетка образует комплементарную нить R-фактора: теперь она устойчива к антибиотику и может передавать R-фактор другим клеткам.
Многие дарвинисты утверждали, что развитие устойчивости к антибиотикам и пестицидам является одним из самых сильных доказательств дарвиновской эволюции (Greenspan,[2] Crews,[3] Iltis,[4] Kopaska-Merkel,[5] и the PBS серии Evolution[6]). В настоящей работе основное внимание уделяется распространенному утверждению о том, что развитие устойчивости к антибиотикам и инсектицидам является доказательством того, что теория эволюции от молекулы к человеку основана на мутациях.
Развитие резистентности вызывает серьезную озабоченность еще по одной причине — здоровье человека. Из истории видно, что инфекционные болезни унесли миллиарды жизней и стали причиной нескольких самых разрушительных эпизодов в истории человечества.[7] В прошлом столетии ученые добились больших успехов в профилактике и лечении инфекционных заболеваний, и создалось впечатление, что современная наука наконец-то позволяет нам «закрыть справочник об инфекционных заболеваниях».[8] Однако, недавние события показали, что этот вывод трагически преждевременен.[9],[10] Двумя основными темами, вызывающими в настоящее время озабоченность в области инфекционных заболеваний, являются «возникающие» инфекционные заболевания и «возвращающиеся» инфекционные заболевания, такие как коклюш. Необходимо понимать как происходит развитие резистентности, чтобы справиться с серьезной угрозой здоровью, которую эта ситуация вызывает.
О бактериях, которые стали устойчивыми к нескольким антибиотикам, говорят, что они обладают множественной лекарственной устойчивостью. В средствах массовой информации их часто называют «супербактериями». Ванкомицин в настоящее время является единственным эффективным средством в борьбе с некоторыми патогенами, но даже он потеряет свою эффективность в последние годы.[11] У этой проблемы много причин, включая неправильное использование антибиотиков и передачу генов резистентности от одной бактерии к другой.[12] Это возможно в связи с тем, что многие бактерии обладают встроенной естественной устойчивостью к ряду антибиотиков, и гены, обеспечивающие эту устойчивость, могут передаваться другим бактериям различными способами.
Механизмы, участвующие в приобретении устойчивости бактерий к антибиотикам
Неустойчивые бактерии обычно становятся устойчивыми несколькими способами, большинство из этих способов не имеют ничего общего с мутациями. Палумби отмечает, что в «большинстве случаев» устойчивость к антибиотикам является результатом отбора существующего генетического признака, и в особенности тех признаков, которые сильно изменчивы, как, например, врожденная защита, которой обладают все организмы.[13] Важным механизмом, благодаря которому бактерии становятся устойчивыми, является получение одного или нескольких специфических генов устойчивости от других бактерий. Так устойчивость может быть приобретена бактерией путем переноса плазмиды (небольших кольцевых единиц ДНК), уже существующей в генофонде другой бактерии, которая несет ген фермента, способного разрушать, либо инактивировать антимикробное вещество.[14] Гены устойчивости также могут перемещаться самостоятельно. Такие гены известны как транспозоны, которые могут «прыгать» с плазмид на хромосомы и наоборот.[15]
Бактерии могут приобретать новый ген (или гены) несколькими способами:
- Конъюгация является наиболее распространенным методом. Это сложная система, которая переносит копию плазмиды от одной бактериальной клетки (называемой донором) к другой бактерии (называемой реципиентом) (рис.1). Трубчатая структура, известная как пиль, прикрепляется к реципиенту и располагается таким образом, что может образоваться коньюгационный мост, позволяющий передавать гены резистентности и не только.[16] Распространенным примером является бактериальная устойчивость к пенициллину, которая приобретается путем получения гена пенициллиназы в результате конъюгации. Пенициллиназа — это фермент, который изменяет молекулу пенициллина таким образом, что она становится неэффективной. Плазмида, содержащая лекарственную устойчивость, называется фактором резистентности (R-плазмида, или R-фактор).
- Трансдукция — это перенос ДНК от одного хозяина к другому при помощи вируса. Бактериальные вирусы, известные как бактериофаги, иногда могут служить посредниками, подбирая ген устойчивости от резистентной бактерии и затем передавая этот ген не имеющим сопротивления бактериям. В этом случае геномы бактерий получают новую информацию, но источником ее не являются мутации. Вместо этого, новый генетический материал получается из генома другой бактерии, которая уже обладает геном (или набором генов), дающим устойчивость.
- Трансформация (процесс, в ходе которого бактерии поглощают экзогенную ДНК из окружающей среды). Хромосомная или плазмидная ДНК может даже быть взята и передана от мертвых к живым бактериям.
Кроме того, участки генома называемые транспозонами, способны передавать сами себя и могут переноситься из своего нормального местоположения в другие плазмиды или хромосомы. У бактерий устойчивые к антибиотикам гены расположены на плазмидах или транспозонах, небольших кольцевых единицах ДНК, которые могут даже распространяться от мертвых к живым бактериям.
Антибиотики могут быть инактивированы различными способами
Антибиотики вырабатываются естественным образом грибами и бактериями. Они сосуществовали с момента их сотворения как части их собственных защитных систем. Без врожденной защиты бактерии не смогли бы защитить себя и вскоре вымерли бы. Когда антибиотик достигает бактериальной периплазмы или цитоплазмы (см. рис.2), он может быть инактивирован путем модификации, выделения или разрушения, что обусловлено не мутациями, а сложными врожденными физиологическими механизмами.
Когда штамм бактерий приобрел устойчивость к антибиотикам, правильнее сказать, что бактерии потеряли чувствительность к антибиотику.[17] Более того, бактерии обладали устойчивостью ко многим антибиотикам задолго до того, как их использовали люди. Это было подтверждено исследованием культур бактерий, найденных на телах исследователей замёрзших насмерть, задолго до того, как появились антибиотики, разработанные человеком. Примером может служить проведенное в 1988 году в Альбертском университете исследование бактерий с тел исследователей Арктики, замерзших в 1845 году. Исследователи обнаружили, что некоторые бактериальные штаммы были устойчивы к антибиотикам.[18] В ходе исследования были изучены шесть штаммов клостридий на трех мужчинах, похороненных в вечной мерзлоте. Было установлено, что эти бактерии устойчивы к клиндамицину и цефокситину — антибиотикам, которые были разработаны более чем через столетие после смерти мужчин.[19] Клостридии являются частью нормальной бактериальной флоры кишечника человека.
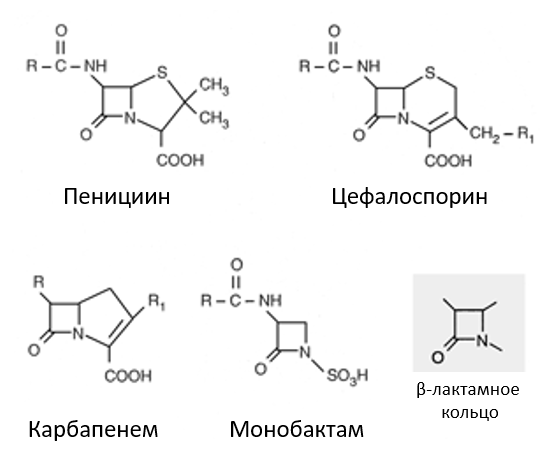
Структура β-лактамных антибиотиков
Препарат также может быть дезактивирован путем модификации основной части его молекулярной структуры. Примером может служить бета-лактамаза — фермент, который атакует пенициллин, в первую очередь разрушая его β -лактамное кольцо. В результате антибиотик перестает быть активным, и поэтому микроорганизмы, производящие β-лактамазу, устойчивы ко всем антибиотикам, содержащим β-лактамное кольцо (известные как бета-лактамные антибиотики, входящие в семейство бета-лактамов). β-лактамаза производится набором генов на R-плазмидах, которые могут быть переданы другим бактериям. В 1982 году более 90% всех клинических стафилококковых инфекций были пенициллин-резистентными, по сравнению с почти 0% в 1952 году. Причина увеличения была обусловлена главным образом быстрым распространением (главным образом путем конъюгации) плазмиды β-лактамазы.
Некоторые антибиотики временно могут быть эффективными, но механизмы восстановления клеток, устойчивые регуляторные системы и последующий синтез белка позже восстанавливают жизнеспособность бактерий. Организм может реагировать на антибиотик, вызывая значительное повышение метаболизма, так что предыдущее количество антибиотика больше не является достаточным для вмешательства в метаболический процесс.
Другой пример включает передачу гена или генов, которые позволяют бактериям-реципиентам производить соединение, заблокированное антибиотиком. Например, сульфонамид блокирует способность бактерий синтезировать фолиевую кислоту. Если один или несколько генов, кодирующих фолиевую кислоту, получены от других бактерий, то это позволяет синтезировать это соединение и делает сульфонамид неэффективным или, по крайней мере, гораздо менее эффективным, обеспечивая бактерии достаточным количеством фолиевой кислоты для выживания.
В связи с неэффективностью пенициллина, врачи часто назначают метициллин, препарат, который отключает другой метаболический механизм, чтобы уничтожить бактерии. К 1980-м годам несколько важных штаммов стафилококков также были устойчивы не только к метициллину, но и к другому лекарственному средству, известному как нафциллин. В 1992 году почти 15% всех стафилококков были устойчивы к метициллину в США, и к 1993 году ванкомицин оставался единственным антибиотиком, который мог убить все его штаммы.[20] Стафилококки находятся повсюду: в почве, на коже человека, в полости рта и легко могут передаваться простым телесным контактом. Большинство из 920 000 послеоперационных инфекций были вызваны стафилококковыми инфекциями, главным образом, метициллин-резистентным штаммом стафилококка. Штаммы стафилококков, устойчивые ко многим лекарственным препаратам, существовали естественным образом к 1990 году. Исследовательская группа лечила инфицированного пациента
«со штаммом, устойчивым к кадмию, пенициллину, канамицину, неомицину, стрептомицину, тетрациклину и триметоприму. Поскольку каждый из этих препаратов действовал по определенным биохимическим путям, которые использовались множеством родственных препаратов, австралийский стафилококк мог сопротивляться, в разной степени, примерно тридцати одному другому препарату. В ходе серии исследований в пробирках, австралийцы показали, что эти различные способности к сопротивлению переносятся различными плазмидами, которые могут быть независимо переданы от одной бактерии к другой. Наиболее распространенным способом передачи была конъюгация: бактерия просто растягивала свою цитоплазму и передавала плазмиды другой».[21]
Основной причиной такой ситуации является чрезмерное использование антибиотиков, которые отбирают для резистентных штаммов, в результате чего они становятся более распространенными.
Транспортеры и эффлюксные насосы
Структура антибиотика ванкомицина.
Еще один метод, с помощью которого бактерии могут стать устойчивыми к антибиотикам — это получение генов для насосов, которые удаляют антибиотик из клетки, прежде чем он сможет причинить вред. Насосы могут удалять многие виды токсинов, включая противораковые препараты. Эффлюксные насосы используют метаболическую энергию для удаления антибиотиков из цитоплазмы, тем самым уменьшая эффективную концентрацию антибиотика внутри клетки. Их называют насосами с множественной лекарственной устойчивостью, они производятся рядом генов (обычно расположенных на плазмидах), которые могут передаваться другим бактериям посредством конъюгации. Насосное устройство прикрепляет белковую метку к лекарству и удаляет ее путем экзоцитоза. Аналогичное семейство механизмов существует как у эукариотов так и у прокариотов. У людей есть суперсемейство транспортеров, таких как человеческий Р-гликопротеин, способный удалять из клеток различные классы амфипатических (имеющие как гидрофобные/липидные, так и гидрофильные/взаимодействующие с водой области) лекарств. Они также являются источником мультирезистентных раковых клеток.[22]
Устойчивость из-за мутаций
Бактерии могут стать устойчивыми в результате мутаций, но все изученные до сих пор случаи являются мутациями потери. Классический пример — стрептомицин и другие микобактериальные препараты, которые оказались неэффективными из-за точечных рибосомальных мутаций.[23,24] Антибиотики мицина действуют путем прикрепления к специфическому участку рецептора на рибосомах бактерий, что препятствует их процессу производства белка. В результате белки, которые производят бактерии, нефункциональны, поэтому бактерии не могут расти, делиться или размножаться. Рибосомы млекопитающих не содержат специфического участка, где могут прикрепляться миозиновые препараты, и по этой причине препарат не оказывает влияния на их рибосомы. Поэтому препараты мицина отрицательно влияют на рост бактерий, не нанося вреда хозяину. Поскольку существуют фундаментальные различия между прокариотическими (бактериальными) и эукариотическими рибосомами, эти различия часто используются при производстве антибиотиков для уничтожения бактерий, не причиняя вреда хозяину.
Бактериальные мутации приводят к тому, что бактерии становятся устойчивыми к стрептомицину, если участок рибосомы, к которому присоединяется стрептомицин, изменяется в результате мутации. В итоге стрептомицин больше не может связываться и, следовательно, больше не вмешивается в работу рибосом. Вызванные мутациями изменения могут происходить в нескольких различных местах рибосомы и все же позволяют бактериям стать устойчивыми к мицину.[25,26] Еще один пример мутации обнаружен в микобактерии туберкулеза, которая производит фермент, изменяющий антибиотик изониазид в его активную форму, а затем убивает бактерию. Мутация, которая повреждает фермент, позволяет антибиотику оставаться в своей в основном неактивной и безвредной форме.[27]
Мутации, изменяющие бактерии, скорее ослабляют организм, и когда он становится устойчивым к лекарству, он, скорее, становится менее приспособленным в других отношениях.[28] Эти модификации не улучшают бактерии, потому что они делают их менее способными выживать в природе.[29] Стрептомицин-резистентные бактерии на самом деле слабее в дикой природе по нескольким причинам. Основная причина заключается в том, что у бактерий, которые становятся устойчивыми к стрептомицину, специфичность рибосом снижается и в результате способность рибосом производить трансляцию определенных транскриптов РНК в белок менее эффективна.[30] Хотя снижение аффинности связывания не всегда приводит к потере или снижению всей специфичности связывания, специфичность белков, необходимых для эффективной функции рибосомы, обычно снижается.
Многочисленные эмпирические исследования показали, что мутации, которые придают лекарственную устойчивость, в то же время, снижают приспособленность бактерий в среде без антибиотиков. В результате они размножаются не так быстро, как нерезистентные бактерии. Фактические данные указывают на то, что эти мутации делают бактерии менее пригодными для жизни в дикой природе, потому что мутантный штамм менее способен конкурировать с диким типом. Например, в одном исследовании сравнивались мультирезистентные туберкулезные бактерии с нерезистентными штаммами. Было обнаружено, что штамм с множественной лекарственной устойчивостью имел значительно более низкую приспособленность по сравнению со штаммом, чувствительным к лекарственным препаратам.[31] Исследование также показывает, что то же самое верно и в отношении вирусов.[32]
Даже если мутация в этом случае дает организму явное преимущество, в дикой природе (т.е. в среде, свободной от антибиотиков) изменение обычно не является преимуществом и обычно не отбирается. Когда лекарственный препарат больше не является частью окружающей среды, нерезистентный тип снова лучше адаптируется, а резистентный тип — меньше.[28] Однако в относительно стерильной больничной среде резистентный штамм имеет явное преимущество у пациентов, получающих антибиотики, поскольку он может сделать многие антибиотики бесполезными.
Классическим примером является пациент, у которого развивается резистентность к антибиотикам в больнице, но инфекция исчезает, когда его отправляют домой, потому что резистентные бактерии не могут конкурировать с нерезистентной нормальной флорой. Было обнаружено, что другие мутации, помимо тех, которые влияют на рибосому, также делают бактерии устойчивыми к стрептомицину. Во всех этих случаях мутация, вызывающая резистентность, является результатом либо деградации, либо потери генетической информации (например, из-за повреждения гена, в результате чего генный продукт перестает функционировать).
Аналогичные примеры естественного отбора также применимы к людям и другим живым существам (например, резистентность, возникающая в результате мутаций, в отличие от естественной резистентности к патогенам, обусловленной нормальной функцией иммунной системы, такой как вакцинация или предварительное воздействие, например, мутация серповидноклеточной анемии у человека, которая придает устойчивость к малярии). Однако, как Schliekelman et al. пишет:
«Хотя инфекционные заболевания считаются важной причиной естественного отбора у людей, сильный отбор в пользу аллелей, которые придают устойчивость к заболеванию, был продемонстрирован только в случае малярии».[33]
То же самое наблюдение было подтверждено и у других, более сложных по строению животных. Очевидно, что устойчивость, обусловленная мутациями, в значительной степени ограничивается вирусами, бактериями и насекомыми.
Рецепторы клеточной поверхности и устойчивость к антибиотикам
Внешняя мембрана грамотрицательных бактерий (тип бактерий, который имеет клеточную стенку, препятствующую окрашиванию определенными красителями) служит барьером для внешнего мира, который защищает клетку. Однако специфические белки (известные как порины) во внешней мембране бактерий служат диффузионными каналами или шлюзами для гидрофильных молекул, таких как некоторые антибиотики. Существует несколько типов поринов. Низкое содержание (или потеря) некоторых поринов из-за разрушающих мутаций увеличивает устойчивость бактерий к некоторым антибиотикам. Причина в том, что они либо больше не могут проникнуть в клетку, либо могут проникнуть небольшие количества, неспособные убить клетку.[34] Гидрофобные молекулы могут диффундировать через саму мембрану, но некоторые мутации, связанные с биохимией внешней мембраны, могут оказывать неблагоприятное влияние на скорость диффузии. Таким образом, эти мутации потенциально повышают лекарственную устойчивость.[35-39] Эти мутации также, закономерно, замедляют поступление некоторых питательных веществ и других необходимых материалов, и в результате эти устойчивые бактерии обычно менее приспособлены, чем обычные бактерии в дикой природе.
Другой мутацией, которая может вызвать резистентность, является дупликация генов, в результате чего, может потребоваться большая доза антибиотика. Это связано с тем, что теперь антибиотик атакует белок, который производится в более высоких количествах.[40] Эта мутация позволяет восстановить нормальный метаболический уровень или, по крайней мере, уровень, который позволяет выжить. В этом случае не создаются новые гены, следовательно, эта мутация не является примером эволюции. Кроме того, в нормальных условиях перепроизводство, опять же, часто вредит.
Изменения молекул клеточной мишени на поверхности клеточной мембраны
Для того чтобы проникнуть в бактериальную клетку, препарат сначала должен связываться с белками клеточной поверхности, называемыми сайтами связывания. Мутации приводят к тому, что многие бактерии становятся устойчивыми к антибиотикам, изменяя белки клеточной поверхности, которые позволяют антибиотику проникать в клетку. Связывание и последующая транспортировка антибиотиков обычно осуществляется одним и тем же белком или белковым комплексом. Некоторая резистентность может возникнуть в результате одного или нескольких изменений этих сайтов связывания препарата на поверхности клетки, так что препарат больше не может связываться. Следовательно, проникновение в клетку предотвращается или затрудняется и поэтому препарат не может с такой же легкостью накапливаться до токсичных значений.
Резистентность также может возникать в результате изменений проницаемости мембран или других изменений на поверхности клетки, которые препятствуют связыванию препарата с клеткой и проникновению в нее.[41,42] Эта мутация также делает организм менее приспособленным в природе, потому что поврежденный рецептор теряет необходимую способность принимать вещества, которые он обычно переносит в клетку.
Другой метод, с помощью которого патогены могут приобрести устойчивость, заключается в изменениях, вызванных мутациями, которые каким-то образом модифицируют клеточную мишень так, что антибиотик перестает быть эффективным. Специфические трансмембранные транспортеры служат для импорта в клетку различных целевых молекул (питательных веществ), но также могут импортировать некоторые антибиотики (например, метаболические аналоги). Мутация или потеря переносчика может снизить количество антибиотика, поступающего в клетку, и, следовательно, он станет менее эффективным. Чтобы попасть в бактериальную клетку, препарат должен пройти как через клеточную стенку, так и через клеточную мембрану. Если уровень проницаемости клеточной мембраны изменяется, препарат теряет способность проходить через нее и в результате не может достичь своей цели, чтобы вызвать повреждение клеток или блокировать размножение клеток (например, связываясь с ДНК или рибосомой). В таком случае, организм приобретает устойчивость к этому препарату, но он также менее способен выжить в дикой природе, потому что мутации, вызывающие резистентность у бактерий, являются мутациями потери, которые делают организм менее пригодным для выживания в среде, не содержащей антител.
Проблема бактериальной резистентности не поддерживает эволюцию. Вместо этого она утверждает разумный замысел. Ни в одном случае не была продемонстрирована мутация, приводящая к получению новой функциональной информации (например, к получению нового гена). Сегодняшняя проблема связана с несколькими факторами, включая использование антибиотиков, которые либо не указаны, либо назначаются в неправильной дозировке или в течение недостаточного периода времени. Эти аспекты также имеют большое значение для профилактики и вакцинации.
Одним из последних примеров является устойчивость Staphylococcus aureus (золотистого стафилококка) к одному из новейших современных антибиотиков — ванкомицину. S. Aureus строит свою клеточную стенку из плотно сшитых нитей. Ген кодирует фермент, который создает «колпачок» на концах нити.[43] Этот колпачок используется для создания поперечных связей, необходимых для создания «прочной жесткой стенки, которая содержит и защищает содержимое клетки».[44] Ванкомицин связывается с концом нити и в результате останавливает дальнейшее образование клеточной стенки.[45] Образующиеся непересекающиеся участки слабы, что позволяет воде проникать при помощи осмоса. В результате клетка раздувается, разрывается и убивает бактерии. Специфическая мутация создает измененный фермент, который, в свою очередь, производит измененный колпачок, на который не влияет ванкомицин. В этом случае мутация явно обеспечивает бактериям преимущество в выживании, но только в ненормальной среде. Но в нормальной обстановке, тем не менее:
«мутантная оболочка приводит к более слабой в сравнении с нормальной, клеточной стенкой и поэтому популяции этих мутантных клеток растут медленнее, чем обычно. Окружающая среда теперь становится решающим фактором. В обычной для клеток окружающей среде, где нет антибиотиков, стафилококки с нормальным геном быстро растут, закрывают свои концы нитей, сшивают их в прочные клеточные стенки и вытесняют стафилококки с мутантным геном» (Выделение добавлено).[44]
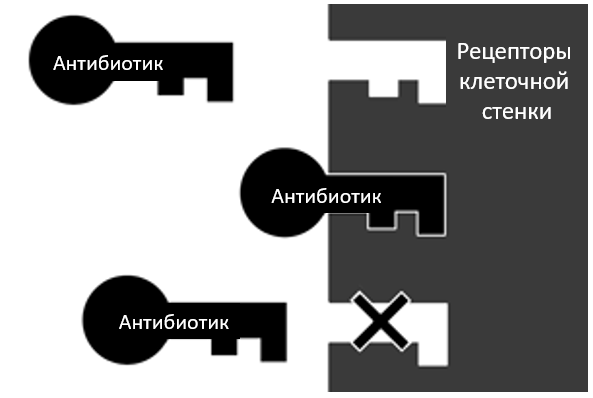
Потеря специфичности рецепторов в клеточной стенке может быть полезной, когда рецептор больше не позволяет антибиотикам проникать в клетку
Устойчивость к инсектицидам
Еще одной серьезной проблемой является устойчивость к инсектицидам. Некоторые насекомые толерантны к такому количеству семейств инсектицидов, что «химический контроль бесполезен».[46] Развитие резистентности к ДДТ у насекомых происходит таким же образом, как и резистентность к стрептомиозину. Инсектицид ДДТ связывается с определенным подходящим участком на мембране нервных клеток насекомого, нарушая функции нервных клеток. Когда определённый уровень ДДТ связывается с нервными клетками, нервная система больше не может нормально функционировать, и в результате насекомое умирает.[47] Любая мутация, отрицательно влияющая на связывание ДДТ с нервной клеткой (если она не является смертельной или почти смертельной) потенциально может придать насекомому устойчивость к ДДТ.[48]
Точно так же, как и в случае с бактериями, насекомые, ставшие устойчивыми к инсектицидам, оказались менее приспособленными к жизни в дикой природе.[49] Например, многие устойчивые насекомые менее активны и медленнее реагируют на раздражители, чем другие насекомые. Этот эффект был специально исследован в случае комаров. Хотя и лучше приспособленные к окружающей среде, в которой присутствует инсектицид, более медленная нервная система приводит к тому, что резистентные насекомые менее приспособлены к нормальной среде, свободной от инсектицидов. Тем не менее, длительное применение инсектицидов может привести к появлению большого числа устойчивых насекомых, которые, хотя и менее приспособлены в целом, могут лучше выживать в среде с высоким уровнем ДДТ. В результате резистентная популяция становится больше, несмотря на то, что нервная система ее членов в целом менее эффективна. Проблема настолько распространена, что большинство насекомых со временем вырабатывают устойчивость ко многим инсектицидам:
«Устойчивость насекомых к пестицидам впервые была зарегистрирована в 1947 году для домашней мухи (Musca domestica) в отношении ДДТ. С тех пор устойчивость к одному или нескольким пестицидам была зарегистрирована, по меньшей мере, у 225 видов насекомых и других членистоногих. Генетические варианты, необходимые для устойчивости к самым разнообразным видам пестицидов, по-видимому, присутствовали в каждой популяции, подвергшейся воздействию этих искусственных соединений».[50]
Отличное резюме для того факта, что устойчивость к пестицидам обычно приводит к явно невыгодному положению для выживания в среде, свободной от токсичных веществ, выглядит следующим образом:
«…устойчивость к ядам редко является «бесплатной» для насекомых или других организмов, потому что селективные компромиссы, навязываемые плейотропией, часто поддерживают полиморфизм либо внутри, либо между популяциями вида. Некоторые популяции норвежских крыс, например, выработали устойчивость к крысиному яду варфарину. Там, где яд широко используется, распространены гомозиготы по аллелю, который придает устойчивость. Но этот аллель также снижает способность крыс синтезировать витамин К — соединение, необходимое для свертывания крови, и они легче подвержены кровотечениям. По этой причине в тех местах, где варфарин не используется, особи, гомозиготные по этому аллелю, демонстрируют целых 54% селективного недостатка по сравнению с крысами «дикого типа», и аллель встречается гораздо реже. Тот же феномен был продемонстрирован для аллелей, которые придают устойчивость к ДДТ и дильдрину у комаров».[51]
Другим доказательством того, что устойчивость к антибиотикам не поддерживает эволюцию, является то, что рост устойчивости к антибиотикам в результате мутаций был чрезвычайно быстрым, потому что мутации должны были только снижать или повреждать функцию ранее существовавших систем (т. е. снизить эффективность связывания белков, повредить транспортные системы клеток или нарушить регуляторный контроль). Обычно требуется только одна мутация (т. е. точечная мутация), чтобы уменьшить или устранить систему, которая уже присутствует в клетке. Эти мутации легко приобретаются, и именно поэтому в результате быстро образуются новые фенотипы. В течение десятилетия или менее после введения нового инсектицида многие насекомые становятся устойчивыми к нему. То же самое верно для бактерий и многих других организмов. Например, ДДТ был открыт в 1939 году, но, по иронии судьбы, устойчивость к нему была отмечена у домашних мух еще до того, как его разработчик, Пауль Мюллер, получил Нобелевскую премию за свою работу.[52]
И наоборот, мутации, которые добавляют новые системы или информацию, такие как новая регуляторная система, новая синтетическая система, новая генерирующая энергию система или новая транспортная система, никогда не были убедительно документированы. Даже дарвинисты соглашаются с этим, не имея подтверждений. Мутации, повышающие сродство ферментов, не являются явно полезными, но могут происходить быстро. Например, мутации в системе гемоглобин-кислород помогают своим носителям акклиматизироваться на большой высоте, но они также вызывают полицитемию (увеличение количества эритроцитов или концентрации гемоглобина в эритроцитах как средство адаптации к низкому уровню кислорода).
Вывод
Недавнее развитие устойчивости бактерий и насекомых не поддерживает неодарвинизм, классически определяемый как естественный отбор мутаций. Эволюция требует создания информационных механизмов, которые добавляют новую информацию в ДНК. Практически во всех случаях устойчивость бактерий или насекомых является результатом эксплуатации существующих систем или обусловлена передачей генов. В редких случаях, когда речь идет о мутации, развитие резистентности включает в себя только мутацию потери, к примеру, такую, которая производит деформированную рибосому. Это подтверждается тем фактом, что устойчивость приобретается очень быстро, за слишком короткий период для эволюционного возникновения сложных биохимических или физиологических систем. Вызванная мутацией резистентность приводит к снижению жизнеспособности в дикой природе, и в результате резистентные популяции не могут конкурировать с нормальными.
Проблема множественной лекарственной устойчивости не так уж мала: она и в настоящее время ежегодно отражается десятками тысяч смертей. Основной причиной этого являются человеческое использование и злоупотребление, а не дарвиновская эволюция. Приобретение устойчивости к антибиотикам не является доказательством эволюции от микроба к человеку, а скорее наоборот, свидетельствует о разумном замысле. Только понимая механизм, описывающий процесс, можно решить проблему устойчивости.[53]
Благодарность
Я хочу поблагодарить Кэвина Андерсона, Давида Дэмика, Берта Томпсона, Джона Вурдомаппе, Клиффорда Лило и Вейна Фрайра за их комментарии к более раннему наброску этой рукописи.
Ссылки и примечания
1. Coyne, J., The case of the missing carpaccio, Nature 412:586–587, 2001; p. 586.
2. Greenspan, N.S., Not-so-intelligent design, The Scientist 16(5):12, 2002.
3. Crews, F.C., Saving us from Darwin, The New York Review of Books, 4 October 2001.
4. Iltis, E., Letters to the Editor, Reports of the National Center for Science Education 20(5):44–45, 2000.
5. Kopaska-Mentel, D., Letters to the Editor, Reports of the Natural Center for Science Education 20(5):44, 2000.
6. Gilder, J., Review of evolution,http://worldnetdaily.com, 2001.
7. Marks, G. and Beatty, W.K., Epidemics, Charles Scribner’s Sons, New York, 1976.
8. Berkelman, R. and Hughes, J., Editorial: The conquest of infectious diseases: who are we kidding? Annals of Internal Medicine 119(5):426–427, 1993; p. 426.
9. Rothman, K.J. and Greenland, S., Modern Epidemiology, 2nd Edition, Lippincott-Raven Publishers, Philadelphia, 1998.
10. Garrett, L., The Coming Plague: Newly Emerging Diseases in a World Out of Balance, Farrar, Straus, and Giroux, New York, 1994.
11. Padiglione, A.A., Grabsch, E.A., Olden, D., Hellard, M., Sinclair, M.I., Fairly, C.K. and Grayson, M.L., Fecal colonization with vancomycin-resistant enterococci in Austria, Emerging Infectious Diseases 6(5):534–536, 2000.
12. Finegold, S.M., Antimicrobial therapy of anaerobic infections: a status report, Hospital Practice 14(10):71–81, 1979.
13. Palumbi, S.R., Evolution—humans as the world’s greatest evolutionary force, Science 293:1786–1790, 2001; p. 1787.
14. Burton, G. and Engelkirk, R, Microbiology for the Health Sciences, Lippincott Williams and Wilkins, Philadelphia, pp. 199–201, 2000.
15. Walkup, L., Junk DNA, Journal of Creation. 14(2):18–30, 2000.
16. Black, L, Microbiology: Principles and Explorations, John Wiley and Sons, New York, 2002.
17. Rowland, M., Fitness of insecticide resistance, Nature 237:194, 1987.
18. McGuire, R., Eerie: human arctic fossils yield resistant bacteria, Medical Tribune, 29 December, 1988, pp. 1, 23.
19. Struzik, E., Ancient bacteria revived, Sunday Herald, 16 September 1990, P. 1.
20. Garrett, Ref. 10, p. 412.
21. Garrett, Ref. 10, p. 413.
22. Chang, G. and Roth, C.B., Research article—Structure of MsbA from E. coli: a homolog of the multidrug resistance ATP binding cassette (ABC) transporters, Science 293:1793–1800, 2001.
23. Davies, L, Brzezinska, M. and Benveniste, R., R factors: biochemical mechanisms of resistance to amino glycoside antibiotics, Annals of the New York Academy of Science 182:226–233, 1971.
24. Davies, J. and Nomura, M., The genetics of bacterial ribosomes, Annual Review of Genetics 6:203–234, 1972.
25. Didier, E. S., Bertucci, D.C. and Leblanc, L., Inhibition of microsporidia growth in vitro, Abstracts of the General Meeting American Society Microbiology 99:11, 1999.
26. Kazanjian, P., Armstrong, V., Hossler, P.A., Burman, V., Richardson, L, Lee, C.H., Crane, L., Katz, J. and Meshnick, S.R., Pneumocystis carinii mutations are associated with duration of sulfa or sulfone prophylaxis exposure in AIDS patients, J. Infectious Diseases 182(2):551–557, 2000.
27. Wieland, C., Antibiotic resistance in bacteria, Journal of Creation 8(l):5–6, 1994; p. 5.
28. Spetner, L., Not By Chance, The Judaica Press, Brooklyn, p. 144, 1997.
29. Wieland, Ref. 27, p. 6.
30. Gartner, T. and Orias, E., Effects of mutations to streptomycin resistance on the rate of translation of mutant genetic information, J. Bacteriology 91:1021–1028, 1966.
31. Davies, A.P., Billington, O.J., Bannister, B.A., Weir, W.R., McHugh, T.D. and Gillespie, S.H., Comparison of fitness of two isolates of mycobacterium tuberculosis, one of which had developed multi-drug resistance during the course of treatment, J. Injection 41(2):184–187, 2000.
32. Martinez-Picado, L, Savara, AY, Sutton, L. and ‘D’Aquila, R.T., Replicative fitness of protease inhibitor-resistant mutants of human immunodeficiency virus type 1, J. Virology 73(5):3744–3752, 1999.
33. Schliekelman, P., Garner, C. and Slatkin, M., Natural selection and resistance to HIV; a genotype that lowers susceptibility to HIV extends survival at a time of peak fertility, Nature 411:545, 2001. Return to text.
34. Penrose, E., Bacterial resistance to antibiotics—a case of un-natural selection, CRSQ 35:76–82, 1998.
35. Chevalier, L, Pages, J.M., Eyraud, A. and Mallea, M., Membrane permeability modifications are involved in antibiotic resistance in Klebsiella pneumoniae, Biochemical and Biophysical Research Communications 274(2):496–499, 2000.
36. De, E., Basle, A., Jaquinod, M., Saint, N., Mallea, M., Molle, G. and Pages, J.M., A new mechanism of antibiotic resistance in Enterobacteriaceae induced by a structural modification of the major porin, Molecular Microbiology 41(l):189–198, 2001.
37. Domenech-Sanchez, A., Hemandez-Alles, S., Martinez-Martinez, L., Benedi, V.J. and Alberti, S., Identification and characterization of a new porin gene of Klebsiella pneumoniae: Its role in beta-lactam antibiotic resistance, J. Bacteriology 181(9):2726–2732, 1999.
38. Wong, K.K., Brinkman, F.S., Benz, R.S. and Hancock, R.E., Evaluation of a structural model of Pseudomonas aeruginosa outer membrane protein OprM, an efflux component involved in intrinsic antibiotic resistance, J. Bacteriology 183(1):367–374, 2001.
39. Cornaglia, G., Mazzariol, A. and Fontana, R., The astonishing complexity of antibiotic resistance, Clin. Microbiol. Infect. 6(Suppl 3):93–94, 2000.
40. Penrose, Ref. 34, p. 78.
41. Cohen, M.L., Epidemiology of drug resistance: implications for a post-antimicrobial era, Science 257:1050–1055, 1992.
42. Gentry, L.O., Bacterial resistance, Orthopedic Clinics of North America 22:379–388, 1991.
43. Yan, H., Zhao, Q, Yuan, J., Cheng, X. and He, B., Affinity adsorbents for the Vancomycin Group of antibiotics, Biotechnology and Applied Biochemistry 31(Pt 1):15–20, 2000.
44. Postlethwait, J.H. and Hopson, J.L., Explore Life, Brooks/Cole Thomson Learning, Australia, p. 220, 2003.
45. Mulichak, A.M., Losey, H.C., Walsh, C.T. and Garavito, R.M., Structure of the UDP-Glucosyltransferase GtfB that modifies the Heptapeptide Aglycone in the Biosynthesis of Vancomycin Group Antibiotics, Structure 9(7):547–557, 2001.
46. Palumbi, Ref. 13, p. 1786.
47. Beeman, R., Recent advances in mode of action of insecticides, Annual Review of Entomology 27:253–281, 1982.
48. Tananka K., Scott J. and Matsumura, E, Picrotoxinin receptor in the central nervous system of the American cockroach; its role in the action of cyclodiene-type insecticides, Pesticide Biochemistry and Physiology 22:117–127, 1984.
49. Panlilio et al. and Toner, M., When bugs fight back; Pulitzer Prize-winning series of reports in the Atlanta Constitution, 23 August–16 October 1992.
50. Ayala, E, The mechanisms of evolution, Scientific American 239(3):56–69, 1978; p. 65.
51. Levine, J. and Miller, K., Biology: Discovering Life, D.C. Heath, Lexington, p. 257, 1994.
52. Palumbi, Ref. 13, p. 1786.
53. Thompson, B., Bacterial antibiotic resistance—proof of evolution? Reason and Revelation 14(8):61–63, 1994.
Если вам понравилась статья, поделитесь ею со своими друзьями в соц. сетях!









 При использовании материалов служения «Апологетика Библии» прямая ссылка на веб-сайт
При использовании материалов служения «Апологетика Библии» прямая ссылка на веб-сайт