Вредные паразиты: проявления Божьего творения?
Автор: Уоррен Шиптон (англ. Warren Shipton)
Источник: creation.com
Перевод: Елена Бондаренко
Редактура: Владимир Силенок
Объяснение наличия кровососущих насекомых, являющихся переносчиками серьезных заболеваний, является сложной задачей. В статье высказаны предположения о появлении малярийного плазмодия и филяриатозных червей. Утверждается, что кровососущие насекомые изначально питались нектаром, медвяной росой, и, возможно, другими насекомыми. Изменения в экспрессии генов, предположительно, привели к использованию чувствующих боль животных в качестве легкого источника питания, необходимого для созревания яиц, функции, первоначально обеспечиваемой в основном растительными источниками. После грехопадения произошли изменения экспрессии генов, изменения в переносе микробов насекомыми и их взаимоотношениях с хозяевами. Представляется, что в результате таких изменений некоторые благотворные или полезные отношения трансформировались во вредные. Изучение одного филяриального червя указывает на то, что он, предположительно, развился из нематодных симбионтов мух, которые его переносят. Происхождение малярийного плазмодия может представлять собой модификацию некоторых связанных с кровью микроорганизмов у лягушек, что дало возможность расширить круг хозяев. Вполне возможно, что при сотворении эти организмы действовали сбалансированно и благотворно. Паразитизм возник по причине утраты генов; экспрессии изначальных генов, но способствующих теперь патологическим жизненным циклам, или других сценариев. Дальнейший прогресс может быть достигнут по мере накопления большего количества информации, что поможет в построении более определенных ответов.
***

Рисунок 1. На изображениях показаны самки комаров рядом (или на них) с личинками насекомых или гусеницами в процессе кормления: A. Личинка Manduca sexta четвертого возраста; B. Личинка Heliothis subflexa четвертого возраста; Самка C. Anopheles stephensi (обведена кружком), напившаяся гемолимфы гусеницы M. sexta. (От Джорджа и др.4)
Когда кто-нибудь смотрит на мир природы и сосредотачивается на пагубных болезнях растений и животных, а также на том, когда беспомощные дети слепнут из-за паразитических червей (филярий), они начинают презирать само понятие Бога. Обратите внимание на следующее высказывание известного эволюциониста сэра Дэвида Аттенборо в качестве иллюстрации.
«Когда креационисты говорят о том, что Бог создал каждый отдельный вид как отдельный акт творения, они всегда приводят в пример колибри или орхидеи, подсолнухи и другие красивые вещи. Но вместо этого я склонен думать о черве-паразите, который просверливает глаз мальчика, сидящего на берегу реки в Западной Африке, [черве], который сделает его слепым. И [я спрашиваю их]: «Вы говорите мне, что Бог, в которого вы верите, которого вы также называете всемилостивым Богом, который заботится о каждом из нас в отдельности, вы говорите, что Бог создал этого червя, который может жить не иначе как в глазном яблоке невинного ребенка? Потому что мне кажется, что это не соответствует Богу, полному милосердия».[1]
Преобразования из взаимоотношений кооперации
Верующие в библейское повествование в целом понимают, что Бог создал основные типы растений, животных и низшие формы жизни. Несомненно, допотопные виды развивались. Во время Потопа сохранились не все виды, а основные или репрезентативные типы животных из-за ограничений несущей способности спасательного сооружения (здесь следует признать, что у нас нет конкретных сведений как спаслись насекомые). Огромная изменчивость, наблюдаемая в настоящее время среди насекомых, означает, что в последующие годы произошли значительные изменения вследствие приспособления к среде обитания и прочих явлений.
Имея в виду эту закономерность, будут даны некоторые предположения о появлении переносчиков болезней и конкретно двух вредных паразитов, поражающих людей. Как читатели вскоре поймут, существуют значительные пробелы в знаниях, но, возможно, будет полезным попытаться построить сценарий, который разумно объясняет окружающий нас мир. И я не берусь дать абсолютно все ответы.
Экология кровососущих насекомых
Ряд кровососущих насекомых участвует в передаче болезней. К ним относятся комары, мухи, блохи, жуки, мотыльки-вампиры, а также клещи. Будут рассмотрены две группы кровососущих насекомых: мошки (Simuliidae) и комары. Мошки являются переносчиками гельминта, возбудителя речной слепоты (Onchocerca volvulus). Комары известны своей способностью переносить малярийного паразита (Plasmodium spp.), вызывающего крайне тяжелое заболевание. Согласно оценкам, почти половина населения мира подвержена риску этого заболевания, которое может привести к истощению и смерти.[2]
С кровососущими насекомыми связан ряд проблем, которые вкратце будут рассмотрены ниже.
Поиск хозяина
Способность кусающих насекомых найти своего хозяина зависит от множества факторов. Колебания уровня углекислого газа являются важными признаками присутствия человека-хозяина для комара, такого как Aedes aegypti. Насекомое летит вдоль шлейфа колеблющейся концентрации молекул, а при приближении к хозяину ему помогают визуальные сигналы и запахи кожи. Приземлению на поверхность кожи способствует изменение температуры и влажности вблизи цели. Однако контекст, в котором возникают стимулы, будет определять их значимость.[3] Питание Anopheles stephensi личинками моли, по-видимому, облегчается способностью обнаруживать градиент углекислого газа и другие сигналы.[4]
Мошкам также требуется сигнал углекислого газа, чтобы оптимизировать их шансы на контакт с хозяином. Визуальные сигналы имеют второстепенное значение.[5] Считается, что высокоспециализированые мошки, вероятно, также обнаруживают особые запахи, связанные с хозяином.[6]
Питание
Комары
Жизненный цикл комаров относительно прост: взрослые особи откладывают яйца на воду или влажные поверхности, подверженные затоплению, где из них вылупляются личинки (мотыль). Личинки питаются микроорганизмами и органикой. Несколько раз происходит линька, затем образуются куколки, из которых на поверхность воды, наконец, выходят взрослые особи. Взрослые особи и личинки представляют собой различные стадии питания.[7]
У взрослых особей есть гибкий хоботок, который подходит для протыкания мягких поверхностей, таких как эпидермис фруктов или кожа животных. Основной пищей как взрослых самцов, так и самок комаров является нектар и медвяная роса. Другими источниками являются поврежденные плоды и листья, сок деревьев, отходы производства сахарного тростника и срыгиваемая жидкость муравьев. Комары родов Toxorhynchites, Topomyia и Malaya обладают ротовым аппаратом, который не может прокалывать кожу позвоночных и не питаются кровью.[8] Комары могут питаться из гусениц, цикад и мелких двукрылых и при этом откладывать жизнеспособные яйца. Несмотря на то, что комары (Aedes aegypti, Culex tarsalis и Anopheles stephensi) могут питаться личинками насекомых и откладывать жизнеспособные яйца, такая пища уступает крови.[4],[9] Поведение питания гусеницами и насекомыми (рис. 1) может помочь объяснить их переход к питанию кровью млекопитающих, если предположить, что они не были факультативными кровососами еще до грехопадения. Питание гемолимфой насекомых, возможно, дало комарам возможность контактировать с комплексом микроорганизмов, способных оказывать на них трансформирующее воздействие.
Наличие хоботка не означает, что популяция комаров использует его для забора крови. Не всем самкам комаров на первый раз требуется кровь для созревания яиц. Для этих комаров богатой белком пищи требуют лишь последующие кладки.[10]
Мошки и слепни (златоглазики)
Мошки и златоглазики являются переносчиками ряда болезней, но в первую очередь здесь речь идет о речной слепоте. Насколько позволяет информация, будут упомянуты африканский глазной червь и его насекомое-переносчик, слепень златоглазик.
Взрослые особи мошек откладывают яйца в водной среде обитания. Из них вылупляются личинки, которые прикрепляются к поверхности субстрата и потребляют различные мелкие пищевые ресурсы (бактерии, водоросли, мелкие водные животные, разнообразную органику), присутствующие в движущихся потоках. Затем следует стадия куколки без питания, и взрослые особи появляются в течение нескольких дней после откладывания яиц. Появляющиеся взрослые особи имеют крылья, и большинству взрослых самок требуется кровь в качестве пищи, что бы яйца могли созреть.[11] Личинки златоглазиков развиваются во влажных местах и питаются почвенной органикой.[12]
Самки некоторых видов златоглазиков и мошек могут производить кладку яиц ещё до того, как употребят кровь (аутогенные виды). Отдельные виды слепней златоглазиков могут удовлетворять потребности в пище из крови рептилий и птиц.[13] Информации о златоглазиках довольно мало, а это означает, что в дальнейшем наше внимание будет сосредоточено на мошках и речной слепоте, а не на африканском глазном черве. Взрослые мошки и златоглазики потребляют нектар и медвяную росу, а также перезревшие гниющие плоды.[14]
Пищеварение
Питание кровью приносит с собой ряд проблем. Во-первых, кровь должна быть переварена. Исследование белков, присутствующих в слюне кровососущих насекомых, показало, что большинство их не имеют определенной функции. Для компонентов с известной функцией основными мишенями являются инактивация факторов каскада свертывания крови, ингибирование активации тромбоцитов и удаление веществ, способных вызывать боль, зуд и отек. Эти особенности проявляются также при анализе содержимого слюнных желез самцов комаров (не питающихся кровью), обнаруженных у тех родов, которые кровью питаются. У них отсутствуют многие соединения, присутствующие у самок, и они содержат меньшее количество компонентов, которые подавляют коагуляцию, активность тромбоцитов и воспаление.[15] Каждая группа насекомых обладает своей собственной уникальной группой белков, которые позволяют им функционировать. Однако во всех случаях мишенью является общая защита хозяина.[16] Наиболее важными ферментными компонентами, идентифицированными у ряда кровососущих насекомых, являются серинпротеазы и их ингибиторы, гиалуронидазы и апиразы.[17]
Развитие яичников
Комары
Стероидные гормоны (экдистероиды) тесно связаны с инициацией образования желтка (вителлогенез) и созреванием яиц.[18] Когда комаров кормят экдистероидами, то стимулируется развитие яиц, включая синтез белка даже при отсутствии кровяной муки в качестве пищи. Подобные соединения могут быть доступны в растениях, которыми питаются комары.[19] Опять же, это придает некоторую достоверность предположению, что растительное питание или питание насекомыми было первоначальным источником пищи для комаров.
Мошки
Опять же, стероидные гормоны (особенно 20-гидроксиэкдизон) важны для созревания яиц. У мошек уровень гормонов повышается по мере развития яиц, а также после кормления кровью, поскольку они синтезируются из пищевого холестерина.[20] Растения обладают способностью синтезировать 20-гидроксиэкдизон (по крайней мере, 78 семейств). Этот стероид структурно идентичен стероиду, обнаруженному у насекомых, и не имеет известной функции у растений, за исключением, возможно, функции отпугивания насекомых.[21] Стеролы, обнаруженные в растениях и грибах, могут использоваться насекомыми для синтеза экдистероидов.[22] В целом, это позволяет сделать предположение, что изначально для созревания яиц мошкам не нужно было потреблять кровь, но скорее они существовали на куколках насекомых или даже на растениях, содержащих достаточное количество экдистероидов и белка.
Взаимоотношения болезнетворных организмов с их переносчиками
Взаимоотношения возбудителей болезней и их переносчиков сложны и обычно включают ряд стадий.
Комары

Рисунок 2. Малярийный паразит (мерозоит), соединяющийся с эритроцитом и начинающий внедряться в него.
Малярийный паразит заносится в кровоток через слюну комара, содержащую клетки паразита (стадия спорозоита). Эти клетки попадают в печень, где размножаются бесполым путем. Когда высвобождаются мерозоиты, они прикрепляются к эритроцитам и и проникают внутрь (рис. 2). В клетках крови происходит рост и размножение паразита, что в конечном итоге приводит к лизису этих клеток. Паразит, который вышел в кровоток, может проникать и в другие эритроциты, чтобы продолжить цикл. При лизисе эритроцитов в кровоток высвобождаются не только паразиты, но также токсины и продукты распада клеток, вызывающие развитие лихорадки. Иногда в эритроцитах происходит другая последовательность событий, когда образуются два типа клеток паразита, которые не разрушают эритроциты. Когда их проглатывает комар, они превращаются в мужские и женские гаметы. Теперь в кишечнике комара происходит ряд событий, которые в конечном итоге приводят к высвобождению спорозоитов, которые мигрируют в слюнные железы и затем могут передаваться через укус новому хозяину.[23]
Мошки

Рисунок 3. Жизненный цикл Onchocerca volvulus.
При укусе насекомого в кровоток попадает личинка филярии третьей стадии развития (рис. 3). Мошки передают зрелых личинок людям, когда муха питается кровью. Они развиваются во взрослых филярий в подкожной соединительной ткани (под кожей формируются узелки). Самки червей производят маленьких червей без оболочки (микрофилярии). Они обнаружены в некоторых жидкостях организма, включая кровь. Прежде чем во время укуса сможет произойти трансмиссия паразита в кровь, в организме мошки происходит серия поступательных событий. Проглоченные микрофилярии проникают в среднюю кишку мошки, затем мигрируют к грудным мышцам, и, наконец, к голове и хоботку.[24]
Происхождение болезнетворных организмов, связанных с кровососущими насекомыми
Независимо от того, произошли ли прародители тех форм жизни, которые мы сейчас наблюдаем, естественным путем или путем сотворения, существуют нерешенные проблемы в создании разумных схем, объясняющих происхождение болезнетворных организмов, передающихся через кровососущих насекомых.
Эволюционные взгляды
Среди эволюционистов существуют различные теории о вероятном пути возникновения болезней, связанных с кровососущими насекомыми. Предлагаемые решения основаны в основном на сравнении генетических, а также других гомологий среди организмов, а затем на разработке путей продвижения от простых организмов к более сложным.
Горизонтальный перенос генов через эндосимбиотические взаимодействия или другие неизвестные процессы считается ответственным за дополнительную сложность, необходимую для объяснения перехода жизни от примитивных форм к сложным. Естественно, в ходе этого процесса в геном реципиента добавляется новая генетическая информация, что необходимо для того, чтобы любая теория эволюционного прогресса заслужила доверие.
Золотым стандартом, используемым эволюционистами в таких исследованиях, является построение филогенетического дерева предположительно родственных видов. При анализе геномов этих видов предположительно устанавливается факт горизонтального переноса генов, когда похожие нуклеотидные последовательность(и) гена идентифицируется у неродственных видов. Даже этот метод столкнулся с трудностями, потому что в первую очередь возникает спор о филогенетических отношениях. Можно использовать и другие методы обнаружения переноса генов, но они считаются менее надежными, чем золотой стандарт. Иногда предполагаемые обмены генами оказывались, что полностью ошибочными.[25] Кроме того, загрязнение также является постоянной проблемой. Рекомендовано предоставлять полные данные о вставленной последовательности, сайтах интеграции, фланкирующих областях генома хозяина, подробном филогенетическом контексте, а также разумный механизм переноса. Такие предосторожности могут не соблюдаться. Это означает, что могут быть легко сделаны ошибочные выводы.[26] К этим проблемам добавляется и то, что систематическая ошибка выборки влияет на интерпретацию результатов даже до такой степени, что в данных, якобы подтверждающих горизонтальный перенос генов, вместо этого могут быть более реалистичны вертикальный перенос и потеря генов.[27]
Основная проблема этого подхода заключается в том, что гомология не указывает на родство. Она просто отражает тот факт, что разные организмы пользуются схожими стратегиями для достижения похожих результатов.
Малярийные паразиты
Путь возможного появления малярийного паразита вызвал значительный интерес. Далее будут упомянуты некоторые из ведущих идей.
Малярийный плазмодий принадлежит к группе организмов, содержащих пластиду (органеллу с двойной мембраной), имеющую заметное сходство с таковой у фотосинтезирующих водорослей, хотя у видов малярийных плазмодиев пластиды утратили способность к фотосинтезу. В соответствии с этой потерей способности многие гены отсутствуют. Предполагаемый путь, ведущий к трансформации непатогенного организма в облигатно патогеный, остается неясным, однако было отмечено, что некоторые роды, родственные возбудителям малярии, паразитируют на морских беспозвоночных. В фокусе научного внимания оказались два рода колпеделлид (Chromera и Vitella). Хромеры тесно связаны с кораллами.[29]
Колподеллиды представляют собой группу одноклеточных эукариотических организмов. Они демонстрируют различные взаимодействия с другими организмами, включая комменсализм, хищничество и паразитизм (внутриклеточный). Они играют решающую роль в регуляции сообществ протистов и водорослей в водных местообитаниях. Было высказано предположение, что если бы эти организмы были так видоизменены, чтобы породить малярийный плазмодий, то с появлением апикомплексанового паразитизма должны были быть связаны горизонтальный перенос, а также потеря генов.[30]
Предполагаемое место, где такое событие могло произойти, находится в кишечнике личинок комара. Проглатывается большое количество пищи, в том числе водоросли, бактерии, диатомовые водоросли, простейшие, коловрате и ракообразные.[31] Поскольку кольподеллиды маленькие (<20 мкм) и их цисты еще более мелкие, а также подвижную стадию зооспоры,[32] проглатывание не представляет собой проблему. Однако не делается никаких предположений о том, как связанные с кораллами организмы (морские) взаимодействовали с личинками комаров (пресноводными/солоноватоводными) или о взаимодействиях, происходящих в слюнных железах и кишечнике личинок комаров, что бы могло помочь провидению или переносу генов в естественной среде.
Другие упоминаемые возможности заключаются в том, что маляриный плазмодий был модифицирован из некоторых паразитов крови лягушек и змей, способных передаваться при проглатывании комаров.[33]
Жизненный цикл двух видов Hepatazoon, обнаруженных у лягушек (Rana), имеет сходство с таковым у малярийных паразитов, включая бесполое размножение в организме лягушек с внедрением мерозоитов в эритроциты и бесполое размножение в комарах. Спороцисты образуются в мальпигиевых сосудах комара и представляют собой завершающую стадию полового цикла. Возбудитель передается лягушкам при проглатывании комаров. Бесполое размножение происходит в печени лягушек с одним циклом мерогонии (от 1 до 2 циклов для Plasmodium). Образовавшиеся мерозоиты внедряются в эритроциты, и затем трансформируются в гамонты (половая стадия) посредством бинарного деления. Комары приобретают паразита, питаясь на инфицированными лягушками.[34] Адаптация таких паразитов к постоянной высокой температуре, характерной для млекопитающих, является одной из проблем, с которыми эти паразиты столкнутся.[35] Ничего не известно о способности видов Herpatazoon выживать в таких условиях. Также возникнут и более фундаментальные вопросы, такие как адаптация метаболизма к новому хозяину и способность избегать уничтожения иммунной системой. Адаптация к человеку в качестве хозяина представляла бы серьезные проблемы, если только он не был генетически запрограммирован на то, чтобы справляться со значительно отличающейся физиологией, включая эндотермию и уникальные особенности иммунного ответа человека.
Такие барьеры, возможно, были менее серьезными, чем предполагалось, поскольку недавно было показано, что в условиях эксперимента мыши могут заразиться паразитом змей Hepatazoon (H. ayorgbor) и, в свою очередь, могут передать возбудителя змеям при употреблении в пищу.[36]
Филярийные паразиты
Мошки часто заражаются нематодами, бактериями, грибками, простейшими и вирусами.[37] Известно, что некоторые нематоды (мерминтиды) заражают личинок мух, и в некоторых случаях эти паразиты сохраняются до стадии взрослых особей. Эти нематоды являются свободноживущими во взрослом состоянии и имеют родство с другими нематодами, паразитирующими на животных и растениях.[38] Кроме того, некоторые нематоды, переносимые мошками, заражают позвоночных, на которых те питаются, и вызывают болезни.[38]
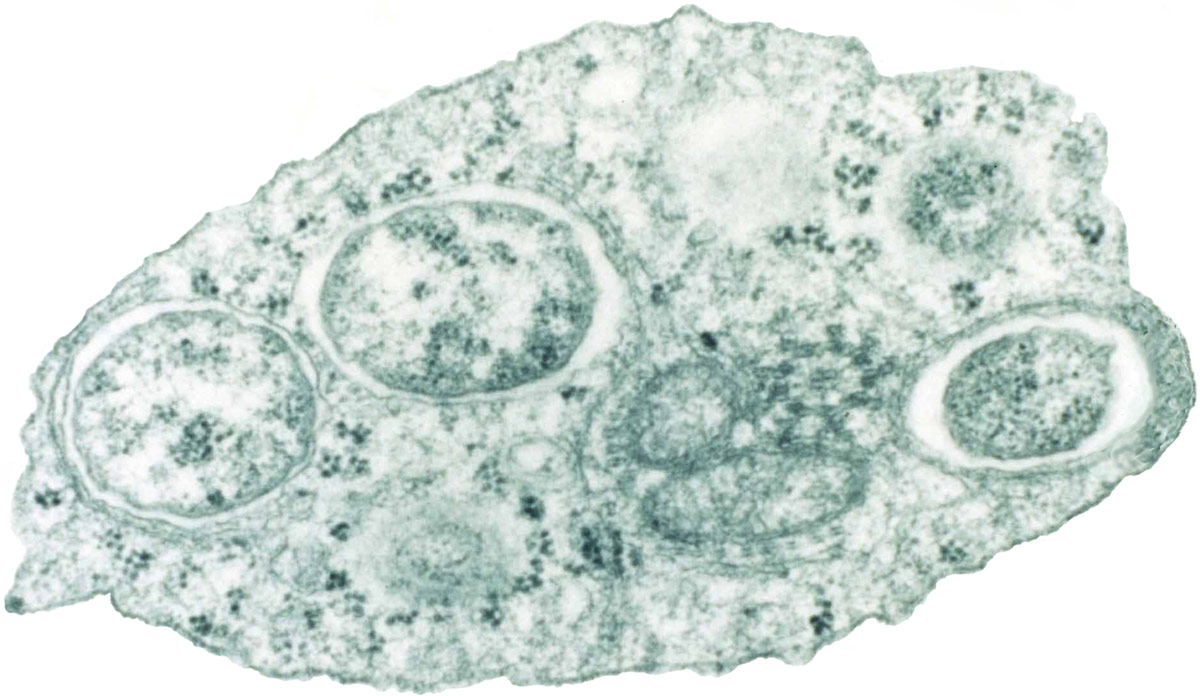
Рисунок 4. Трансмиссионная электронная микрофотография Wolbachia в клетке насекомого.
Такая инфекция была связана с данными, полученными при изучении бактерий Wolbachia (рис. 4), которую переносят многие филяриальные паразиты, в том числе O. volvulus (нематода речной слепоты). Бактерии передаются следующему поколению насекомых через яйца. По-видимому, бактерии способствуют паразитарной природе червей на других хозяевах или мешают иммунному ответу хозяина. Действительно, антибиотики могут лишить нематод способности вызывать заболевания, что доказывает, что Wolbachia выполняет жизненно важную функцию в образе жизни нематод.[39]
В некоторых кругах, перенос генов от бактерий Wolbachia к членистоногим и нематодам (эукариотам), которые являются их носителями, преподносится как что-то реально возможное, поскольку эти организмы тесно связаны с клетками зародышевой линии. Интригующий пример предполагаемого переноса был приведен у жука Callosobruchus chinensis. Гены в Х-хромосоме жука идентичны генам переносимой им бактерии.[40] Бактерии Wolbachia, которые многочисленны и широко распространены среди насекомых, не существуют самостоятельно, а также управляют репродуктивной биологией насекомых.[41]
Одна из проблем с африканским глазным червем заключается в том, что он не переносит бактерии Wolbachia. Однако считается, что остатки генных последовательностей бактерий присутствуют у африканского глазного червя (филяриатозной нематоды), а также родственного ему червя паразита грызунов (Acantocheilonema vitaeae).[42] Если это так, то эти генетические последовательности или другие изменения, вызванные вставкой генетического материала, можно считать потенциально ответственными за патогенные способности, проявляемые теперь глазным червем-паразитом.[43]
Креационистские взгляды — что изменилось сразу после грехопадения?
Было бы спекулятивно предполагать, что насекомые с жалящим ротовым аппаратом использовали фрукты и другие растительные ткани в качестве своего первоначального источника пищи, а их переход к питанию кровью мог развиться после грехопадения. Однако у взрослых самцов бабочек Calyptra thalictri, питающихся плодами, наблюдается очевидная адаптация к питанию кровью, что может придать некоторую силу такому аргументу.[44]
Многие таксоны среди членистоногих и нематод образуют симбиотические отношения с прокариотами. Эти симбиотические организмы могут обеспечивать необходимые питательные вещества и другие факторы, необходимые для их размножения и выживания. Преимущества могут распространяться на такие сферы как: обеспечение защиты от повреждающих организмов и уменьшение стресса от факторов окружающей среды. Не все эти бактерии теперь могут приносить пользу хозяину. Те бактерии, которые имеют успешные полезные отношения с хозяевами, обладают меньшими геномами, чем их свободноживущие родственники.[45]
Можно разумнго полагать, что обоюдовыгодные (мутуалистические) отношения между живыми организмами были нормой творения. Это предположение подтверждается наблюдением, что большинство растений формируют такие отношения с микроорганизмами, а другие группы живых организмов находятся в сильно зависимых отношениях с неродственными группами.[46]
Среди некоторых креационистов есть и другое мнение, согласно которому смерть организмов, не способных осознавать боль, происходила и до грехопадения (например, птицы поедали насекомых; фагоциты в теле млекопитающих избавляются от бактерий, попадающих в кровоток). Некоторые предпочитают думать, что работали механизмы отрицательной репродуктивной обратной связи. Когда бы болезнетворные микроорганизмы ни возникли, с разной степенью успеха их появление может быть объяснено при помощи известных явлений, облегчающих перенос генов (трансформация, трансдукция и анастомоз), как было показано в другом месте.[47] Было показано, что некоторые из этих и связанных с ними явлений вызывают появление новых возбудителей в природе.
После грехопадения функции человеческого тела стали работать неоптимально (Бытие 3:16 — роды). Это, возможно, дает право предположить, что сбои и ошибки могут быть отмечены и в других формах жизни, связанных с целым рядом процессов. Из приведенного выше текста можно было ожидать, что такие изменения начнут проявляться в краткосрочной перспективе.
Изменения во времени

Рисунок 5. Личинки Wyeomyia smithii в кувшиновидном листе Sarracenia purpura.
Для креационистов наиболее привлекательными кажутся теории, рассматривающие в качестве отправной точки хищнические отношения между насекомыми (насекомые-энтомофаги), и/или насекомые, питающиеся растениями.[48] Существенным моментом является то, что обе группы насекомых, которым посвящена эта статья, обладают способностью прокалывать поверхности и получать питание из живых тканей. Мы аккуратно отмечаем, что эта способность есть у форм жизни, не обладающих сознательным чувством боли.
Способность комаров кусать млекопитающих
Относительно малярии сделаны некоторые предположения, которые могут понравиться креационистам. Wyeomyia smithii – это вид комаров, который живет как комменсал в заполненных водой полостях листьев растения саррацения пурпурная (Sarracenia purpurea – рис. 5).[49] Были идентифицированы кусающие, равнодушно-некусающие и облигатно некусающие популяции этого комара. Эти популяции полностью интерфертильны. Склонность кусать в популяции с низким уровнем укусов может быть увеличена при помощи селективных манипуляций.[50] Если при сотворении отправной точкой была группа облигатно не кусающих комаров, то это якобы делает аргумент более удобным. Однако переход к привычке питания на млекопитающих поставил бы комара перед проблемой приобретения способности переваривать гемм и бороться с токсичными метаболитами. Это может представлять собой значительные препятствия. Дальнейшие успехи в объяснении будут возможны по мере того, как ученые исследуют способности, которыми обладают как кусающие, так и некусающие насекомые.[51]
Неудивительно, что среди трех популяций были выявлены различия в экспрессии генов, причем наибольшая разница наблюдается между популяцией кусающих и популяцией облигатно некусающих комаров. Разница в дифференциальной экспрессии генов между этими двумя популяциями составляла пять процентов. Облигатно некусающие комары были более гибкими в своей способности адаптироваться к изменяющимся условиям окружающей среды. Кусающие, с другой стороны, из-за приема питания кровью несут затраты с точки зрения метаболической активности, такой как необходимость расщепления гемоглобина, выведения высвобождаемых токсинов и акцентирования внимания на обонянии, а не на зрительных ощущениях во время поиска источника пищи. Некоторые различия могут быть объяснены изменениями уровней экспрессии генов. В отличие от предположения, которое было бы удобно креационистам, предполагаемая эволюционная последовательность такова: от кусающих к облигатно не кусающим.[52]
Если рассматривать ферменты слюнных желез в целом, то наиболее значимыми ферментными компонентами, идентифицированными у ряда кровососущих насекомых, являются сериновые протеазы и их ингибиторы, гиалуронидазы и апиразы. Подобные ферменты были обнаружены в царстве растений и среди некоторых бактерий. Никто не дал убедительного объяснения того, как кровососущие насекомые приобрели эти ферменты.[17] Возможно ли, что соответствующие гены и небольшое количество ключевых ферментов присутствовали в популяции насекомых, а отбор и повышенная экспрессия генов имели место после грехопадения? В качестве альтернативы или в дополнение к этому мог иметь место микробный перенос генов при помощи фага, несущего регуляторные факторы, способные увеличивать экспрессию генов.
Было отмечено, что активность гиалуронидазы может кодироваться фагом или быть связана с фаговой частицей, как у стрептококков.[53] Также было замечено, что геном комара содержит последовательности подобные тем, что есть у растений. Было высказано предположение, что они могли быть приобретены в результате такого поведения насекомого как питание растениями при помощи уникальной микробиоты, присутствующей в его слюнных железах и средней кишке.[54] Концептуально это может быть вероятным, возможно, после событий, отмеченных у хлореллоподобной зеленой водоросли. Когда эту водоросль заразили вирусом, несущим ген гиалуронансинтазы, водоросль приобрела способность синтезировать продукт гена в течение 15–30 минут после заражения. Репрезентативный полисахарид (гиалуроновая кислота) появился на внешней стороне её клеточной стенки.[55]
Происхождение малярийных паразитов
Происхождение малярийного паразита остается загадкой, но наибольшая вероятность, по-видимому, связана с группой апикомплексных организмов, обнаруженных у лягушек. Вполне возможно, что паразиты, относящиеся к современному роду Hepatazoon, были спутниками лягушек при сотворении и не оказывали на этих существ неблагоприятного воздействия. Эта ситуация могла измениться после грехопадения. Сегодня виды Hepatazoon обнаруживаются у лягушек и демонстрируют много общего с жизненным циклом, который в настоящее время демонстрирует малярийный плазмодий, и, кроме того, они могут передаваться комарами, как упоминалось в последнем разделе. Выдвинутое здесь предположение состоит в том, что изначально эти паразиты жили в сбалансированных отношениях с хозяином, не вызывая неблагоприятных последствий и, возможно, даже принося некоторую пользу. У некоторых животных такие предполагаемые отношения могут иметь сходство с теми, которые наблюдаются и в настоящее время.[56]
Изменение сложных взаимодействий между паразитами и их хозяевами и между микробами в хозяине может иметь драматические последствия. У комаров модификация иммунного ответа насекомого путем манипуляции генами фактора транскрипции делает его почти полностью устойчивым к передаче малярийного паразита,[57] что иллюстрирует влияние небольших изменений в структуре гена на конечные результаты.
Виды комаров, имеющие первостепенное значение как хозяева малярийных паразитов, обычно не являются переносчиками бактерий Wolbachia. Их способность к этому может быть значительно снижена, если бактерия введена искусственно, как и способность передавать два возбудителя вирусных заболеваний.[58] Как могла произойти предполагаемая потеря Wolbachia, изменение ключевого транскрипционного фактора или другие связанные изменения — в настоящее время не известно.
Мошки и филярийные паразиты
Дать удовлетворительное объяснение аппетита мошек к крови и их способность передавать филяриатозных паразитов труднее, чем для малярийных комаров. Было отмечено, что не все мошки с хорошо развитыми челюстями кусаются.[59] Теоретически, находящиеся в крови питательные вещества могут быть доступны и из растительных источников.[21]
Возможно ли, что филяриатозные паразиты произошли от мерминтидных нематод, паразитирующих на мошках, при помощи бактериальных симбионтов? Ясно, что этот процесс был бы длительным, поскольку для начала необходимо объяснить наличие болезнетворных нематод, паразитирующих на мошках. Потенциально это может означать, что некоторые нематоды были созданы для регулирования популяций насекомых. Известны примеры такого регулирования. Некоторые из этих нематод связаны с бактериальными симбионтами, которые помогают им в их контролирующей деятельности.[60]
Манипуляции экспрессией генов через микробиоту у насекомых
Возможно ли, что ДНК эндосимбиотических бактерий могла быть включена в ядро эукариотического хозяина и изменить его функцию? Чтобы ответить на этот вопрос, можно привести несколько примеров. Например, гороховой тле (Acyrthosiphon pisum) для своего существования требуется присутствие симбиотической бактерии (Buchnera), и бактерия также нуждается в тле. На стадиях развития хозяина, клетки бактерии и зародышевой линии не разделены мембранами. Некоторые гены тли похожи на гены прокариот, и они необходимы для сохранения жизнеспособности. Откуда взялись эти гены — сложный вопрос, поскольку кажется, что они похожи на гены бактерий, которые лишь спорадически присутствуют у этих насекомых. Эта закономерность наблюдается и у других исследованных насекомых — ДНК берется не от симбиотических бактерий, присутствующих обычно.[61] Действительно, признано, что многие гены прокариотного типа появляются у эукариот. Нам нужно еще раз указать, что сходство генов в природе не обязательно указывает на первоначальный источник происхождения гена или на то, был ли «гомологичный» ген создан независимо в нескольких таксонах.
Изменение сложных взаимодействий между паразитами и их хозяевами, а также между микробами в хозяине может иметь драматические последствия. Иммунный ответ комаров можно модифицировать путем манипуляций с факторами транскрипции, так что они становятся почти полностью устойчивыми к передаче малярийного паразита.[63] Это представляет собой область, заслуживающую более тщательного изучения. Как уже упоминалось, виды комаров-носителей малярийных паразитов обычно не являются переносчиками бактерий Wolbachia. Их способность быть переносчиками может быть значительно снижена, если бактерия введена искусственно.[58] Возможно ли, что предполагаемая потеря Wolbachia была ключевым событием в появлении малярии в ее нынешней форме?
Заключительные замечания
Учет наличия деструктивных паразитов является сложной задачей. Некоторый прогресс был достигнут в этом направлении с комарами и мошками. Предполагается, что в отношении обеих этих групп изначально имело место питание растениями и даже беспозвоночными. У этих насекомых теперь были бы расширенные возможности сбора пищи, предположительно приобретенные по мере того, как экологические условия изменились, а пищевые ресурсы стали более скудными и менее питательными в результате Проклятия. В качестве альтернативы могло произойти рассредоточение по другим местам, что дало больше возможностей для сбора пищи. Возможно, многие из этих изменений объясняются адаптивными процессами. Это может включать в себя изменение экспрессии первичного генетического материала или информацию, поступающую извне в результате горизонтального переноса с помощью микробов. В настоящее время у нас нет подробных знаний о насекомых, ферментах их слюны, изменяющихся состояниях, паразитах, которых они переносят, ассоциированных бактериях, влияющих на эти отношения, горизонтальном переносе генов и других неизвестных, чтобы делать какие-либо убедительные заявления.
Происхождение возбудителя малярии и паразита речной слепоты, переносимого насекомыми, также создает проблемы. Однако проблемы гораздо хуже для тех, кто подходит к проблеме с натуралистической эволюционной точки зрения. Паразитические нематоды, способные контролировать популяции насекомых, являются возможным источником возникновения паразита речной слепоты. Такое событие повлекло бы за собой изменение экологической ниши для переносчика и паразита, предположительно произошедшее посредством переноса генов: приобретение и/или утрата генов при помощи известных механизмов. Комары являются хозяевами нематод, грибков, бактерий, протистов, вирусов и других микроорганизмов. Сходство малярийного паразита с переносимыми комарами микробами лягушек предполагает и возможное происхождение. Предполагаемая потеря бактерии, ассоциированой с комарами, могла способствовать появлению способности паразита развиваться в его нынешней форме.
Предлагаемые эволюционистами широкие перемещения генетической информации между признанными родами часто не могут быть осуществлены в лаборатории и во многих случаях не сопровождаются разумными предположениями о механизмах, которые облегчили бы такой обмен в природе. Это означает, что многие из построенных наследственных схем не имеют прочного основания. Во всех случаях, когда генетический обмен был продемонстрирован экспериментально, организм-реципиент по-прежнему узнаваем. Он мог приобрести какие-то новые способности или утратить какие-то способности, но его основные структурные и функциональные особенности распознаются как принадлежащие к определенной группе организмов.
Ссылки и примечани
- Buchanan, M, Wild, Wild Life, Sydney Morning Herald, The Guide, p. 6, 24 March 2003; quoted in McIntosh, A. and Hodge B., How did defense/attack structures come about? in: Ham, K. (Ed.), The New Answers Book, Master Books, Green Forest, AR, 1:259–270, 2012.
- World Health Organization, Malaria, 2016, www.who.int/mediacentre/factsheets/fs094/en/
- Cardé, R.T., Mulit-cue integration: how female mosquitoes locate a human host, Current Biology 25(18):R793–R795, 2015 | doi:10.1016/j.cub.2015.07.057.
- George, J., Blanford. S., Thomas, M. B., and Baker, T.C., Malaria mosquitoes host-locate and feed upon caterpillars, PLoS ONE 9(11):e108894, 2014 | doi:10.1371/journal.pone.0108894.
- Sutcliffe, J.F., Steer, D.J., and Beardsall, D., Studies of host location behaviour in the black fly Simulium arcticum (IIS-1O.11) (Diptera: Simuliidae): aspects of close range trap orientation, Bulletin of Entomological Research 85(3):415–424, 1995.
- Gullan, P.J. and Cranston, P.S., The Insects: An outline of entomology, 3rd edn, Blackwell Publishing Ltd., Malden, MA, 2005.
- World Health Organization, Mosquito ecology, 1967, apps.who.int/iris/handle/10665/40662.
- Calvo, E., Pham, V.M., and Ribeiro, J.M., An insight into the sialotranscriptome of the non-blood feeding Toxorhynchites amboinensis mosquito, Insect Biochemistry and Molecular Biology 38(5):499–507, 2008 | doi:10.1016/j.ibmb.2007.12.006; Hien, D.F. d.S., Dabiré, K.R., Roche, B. et al., Plantmediated effects on mosquito capacity to transmit human malaria, PLoS Pathogens 12(8):e1005773 | doi:10.1371/journal.ppat.1005773; Foster, W.A., Mosquito sugar feeding and reproduction energetics, Annual Review of Entomology 40:443–474, 1995; Rattanarithikul, R., Harbach, R., Harrison, B.A., Panthusiri, P., and Coleman, R.E., Illustrated keys to the mosquitoes of Thailand, V. Genera Orthopodomyia, Kimia, Malaya, Topomyia, Tripteroides, and Toxorhynchites. Southeast Asian Journal of Tropical Medicine and Public Health 2:1–65, 2007; Spielman, A., Bionomics of autogenous mosquitoes, Annual Review of Entomology 16:231–248, 1971. .
- Harris, P. and Cooke, D., Survival and fecundity of mosquitoes fed on insect haemolymph, Nature 222(5200):1264–1265, 1969.
- Spielman, ref. 8.
- McCreadie, J.W., Adler, P.H., and Beard, C.E., Ecology of symbiotes of larval black flies (Diptera: Simuliidae): distribution, diversity, and scale, Environmental Entomology 40(2):289–302, 2011 | doi:10.1603/EN10258; Pennsylvania Government, Department of Environmental Protection, Black fly–Biology, 2019, dep.pa.gov/Business/Water/CleanWater/BlackFly/Pages/Biology.aspx.
- McKeever, S. and French, F E., Fascinating beautiful blood feeders: deer and horse flies, the Tabanidae, American Entomologist, Winter, 217–226, 1997; Steel, B., Chrysops excitans, 2014, Animal Diversity Web, animaldiversity.org/accounts/Chrysops_excitans/.
- Hunter, B., Rohner, C., and Currie, D.C., Black-flies and Leucocytozoan spp. as causes of mortality in juvenile giant horned owls in the Yukon, Canada; in: Duncan, J.R., Johnson, D. H., and Nicholls, T.H. (Eds), Biology and Conservation of Owls of the Northern Hemisphere, 2nd International Symposium, General Technical Report NC-190, US Department of Agriculture, Forest Service, North Central Forest Experiment Station, St Paul, MN, pp. 243–245, 1997.
- Burgin, S.G. and Hunter, F.F., Nectar versus honeydew as sources of sugar for male and female black flies (Diptera: Simuliidae), J. Medical Entomology 34(6):605–608, 1997 | doi: 10.1093/jmedent/34.6.605; Ossowski, A. and Hunter, F.F., Distribution patterns, body size, and sugar-feeding habits of two species of Chrysops (Diptera: Tabanidae), Canadian Entomologist 132(2):213–221, 2000.
- Calvo et al., ref. 8; Foster, ref. 8; Spielman, ref. 8.
- Mans, B.J., Evolution of vertebrate hemostatic and inflammatory control mechanisms in blood-feeding arthropods, J. Innate Immunity 3(1):41–51, 2011.
- Chagas, A.C., Calvo, E., Pimenta, F.F.P. et al., An insight into the sialome of Simulium guianense (Diptera: Simuliidae), the main vector of River Blindness Disease in Brazil, BMC Genomics 12:612, 2011 | doi:10.1186/1471-2164-12-612.
- Wu, Q. and Brown, M. R., Signaling and function of insulin-like peptides in insects, Annual Review of Entomology 51:1–24, 2006.
- Ohtaki, T., Milkman, R.D., and Williams, C.M., Ecdysone and ecdysone analogues: their assay on fleshfly Sarcophaga peregrine, PNAS 58(3):981–984, 1967; Spielman, A., Gwadz, R.W., and Anderson, W.A., Ecdysone-initiated ovarian development in mosquitoes, J. Insect Physiology 17(10):1807–1814, 1971.
- Noriega, R., Ramberg, F.B., and Hagedorn, H.H., Ecdysteroids and oocyte development in the black fly Simulium vittatum, BMC Developmental Biology 2:6, 2002 | doi:10.1186/1471-213X-2-6.
- Adler, J.H. and Grebenok, R.J., Occurrence, biosynthesis, and putative role of ecdysteroids in plants, Critical Reviews in Biochemistry and Molecular Biology 34(4):253–264, 1999.
- Nation, J.L., Insect Physiology and Biochemistry, 2nd edn, CRC Press, Boca Raton, FL, pp. 135–136, 2008.
- Willey, J.M., Sherwood, L.M., and Woolverton, C.J., Prescott’s Microbiology, 8th edn, McGraw-Hill International, New York, p. 332, 2011.
- Centers for Disease Control and Prevention, Onchocerciasis, 2017, cdc.gov/dpdx/onchocerciasis/index.html.
- Stanhope, M.J., Lupas, A., Italia, M.J. et al., Phylogenetic analysis do not support horizontal gene transfers from bacteria to vertebrates, Nature 441:940–944, 2001.
- Wijayawardena, B.K., Minchella, D.J., and DeWoody, J.A., Host, parasites, and horizontal gene transfer, Trends in Parasitology 29(7):329–338, 2015.
- Gluck-Thaler, E. and Slot, J.C., Dimensions of horizontal gene transfer in eukaryotic microbial pathogens, PLoS Pathogens 11(10):e1005156, 2015 | doi:10.1371/journal.ppat.1005156.
- Janouškovec, J., Horák, A., Oborník, M. et al., A common red algal origin of the apicomplexan, dinoflagellate, and heterokont plastids, PNAS 107(24):10949– 10954, 2010; Woo, Y.H., Ansari, H., Thomas, O.D. et al., Chromerid genomes reveal the evolutionary path from photosynthetic algae to obligate intracellular parasites, Genomics and Evolutionary Biology 4:e06974, 2015 | doi:10.7554/eLife.06974.
- Moore, R.B., Oborník, M., Janouškovec, J. et al., A photosynthetic alveolate closely related to apicomplexan parasites, Nature 451:959-963, 2008; Woo et al., ref. 28
- Brugerolle, G., Cryptophagus subtilis: a new parasite of cryptophytes affiliated with the Perkinozoa lineage, European J. Protozoology 37(4):379–390, 2002; Brugerolle, G., Colpodella vorax: ultrastructure, predation, lifecycle, mitosis, and phylogenetic relationships, European J. Protistology 38(2):113–125, 2002; Templeton, T.J. and Pain, A., Diversity of extracellular proteins during the transition from the ‘proto-apicomplexan’ alveolates to the apicomplexan obligate parasites, Parasitology 143(1):1–17, 2016 | doi:10.1017/S0031182015001213;Yuan, C.L., Keeling, P.J., Krause, P.J. et al., Colpodella spp.–like parasite infection in woman, China, Emerging Infectious Diseases 18(1):125–127, 2012 | doi:10.3201/eid1801.110716.
- Merritt, R.W., Dadd, R.H., and Walker, E.D., Feeding behaviour, natural food, and nutritional relationships of larval mosquitoes, Annual Review of Entomology 37:349–376. 1992.
- Leander, B.S., Kuvardina, O.N., Aleshin, V.V. et al., Molecular phylogeny and surface morphology of Colpodella edax (Alveolata): insights into the phagocytic ancestry of apicomplexans, J. Eukaryotic Microbiology 50(5):334–340, 2003.
- Barta, J.R., Ogedengbe, J.D., Martin, D.S. et al., Phylogenetic position of the adeleorinid coccidia (Myzozoa, Apicomplexa, Coccidia, Eucoccidiorida, Adeleorina) inferred using 18A rDNA, J. Eurkaryotic Microbiology 59(2):171–180, 2012; Smith, T.G., Kim, B., Hong, H. et al., Intraerythrocytic development of species of Hepatozoon infecting ranid frogs: evidence for convergence of life cycle characteristics among apicomplexans, J. Parasitology 86(3):451–458, 2000.
- Desser, S., Hong, H., and Martin, D.S., The life history, ultrastructure, and experimental transmission of Hepatozoon catesbianae n. comb., an apicomplexan parasite of the bullfrog, Rana catesbeina and the mosquito, Culex territans in Algonquin Park, Ontario, J. Parasitology 81(2):212–222, 1995; Ferguson, L.V., Hillier, N.K., and Smith, T.G., Influence of Hepatazoon parasites on host-seeking and host-choice behaviour of the mosquitoes Culex territans and Culex pipiens, International J. Parasitology: Parasites and Wildlife 2:69–76, 2013; Leander, B.S., Lloyd, S.A.J., Marshall, W. et al., Phylogeny of marine gregarines (Apicomplexa)–Pterospora, Lithocystis and Lankesteria–and the origin(s) of coelomic parasitism, Protist 157(1):45–60, 2006; Maxwell, R.D., Gregarines and Haemogregarines; in: Kreir, J.P. (Ed.), Gregarines, Haemogregarines, Coccidia, Plasmodia, and Haemoproteids, Academic Press Inc., London, pp. 1–32, 1977.
- Jancarova, M., Hlavacova, J., Votypka, J. et al., An increase of larval rearing temperature does not affect the susceptibility of Phlebotomus sergenti to Leishmania tropica but effectively eliminates the gregarine Psychodiella sergenti, Parasites and Vectors 9:553, 2016 | doi: 10.1186/s13071-016-1841-6.
- Sloboda, M., Kamler, M., Bulantova, J. et al., Rodents as intermediate hosts of Hepatozoon ayorgbor (Apicomplexa: Adeleina: Hepatozoidae) from the African ball python, Python regius, Folia Parasitologica 55:13–16, 2008.
- Pennsylvania Government, ref. 11.
- De Ley, P., A quick tour of nematode diversity and backbone of nematode phylogeny, WormBook, 2006, wormbook.org/chapters/www_quicktourdiversity/quicktourdiversity.html; McCreadie et al., ref. 11.
- Ferri, E., Bain, O., Barbuto, M. et al., New insights into the evolution of Wolbachia infections in filarial nematodes inferred from a large range of screened species, PLoS One 6(6):e20843, 2011 | doi:10.1371/journal.pone.0020843; Wu, B., Novelli, J., Jiang, D. et al., Interdomain lateral gene transfer of an essential ferrochelatase gene in human parasitic nematodes, PNAS 110(19):7748–7753, 2013.
- Nikoh, N., Tanaka, K., Shibata, F. et al., Wolbachia genome integrated in an insect chromosome: evolution and fate of laterally transferred endosymbiont genes, Genome Research 18(2):272–280, 2008.
- Bouchery, T., Lefoulon, E., Karadjian, G. et al., The symbiotic role of Wolbachia in Onchocercidae and its impact on filariasis, Annual Review of Ecology and Systematics 32:519–545, 2001; Werren, J.H., Biology of Wolbachia, Annual Review of Entomology 42:587–609, 1997.
- Ferri et al., ref. 40; Desjardins, C.A., Cerqueira, G.C., Goldberg, J.M. et al., Genomics of Loa, a Wolbachia-free filarial parasite of humans, Nature Genetics 45(5):495–500, 2013 | doi:10.1038/ng.2585; McNully, S.N., Foster, J.M., Mitreva, M. et al., Endosymbiont DNA in endobacteria-free filarial nematodes indicates ancient horizontal genetic transfer, PLoS One 5(6):e11029, 2010 | doi:10.1371/journal.pone.0011029.
- Scott, A.L., Ghedin, E., Nutman, T.B. et al., Filarial and Wolbachia genomics, Parasite Immunology 34(2–3):121–129, 2012.
- Hill, S.R., Zaspel, J., Weller, S., Hansson, B.S., and Ignell, R., To be or not to be… a vampire: a matter of sensillum numbers in Calyptra thalictri? Arthropod Structure and Development 39(5):322–333, 2010.
- Moran, N.A. and Bennett, G.M., The tiniest tiny genomes, Annual Review of Microbiology 68:195–215, 2014; Moya, A., Peretó, J., Gil, R. et al., Learning how to live together: genomic insights into prokaryote-animal symbioses, Nature Reviews Genetics 9:218–229, 2008.
- Brundrett, M.C., Coevolution of roots and mycorrhizas of land plants, New Phytologist 154(2):275–304, 2002; Hamel, C., Impact of arbuscular mycorrhizal fungi on N and P cycling in the root zone, Canadian J. Soil Science 84(4):355–363, 2004.
- Shipton, W.A., Origins of pathogenic microbes: part 1—bacteria, J. Creation 30(2):76–82, 2016; Shipton, W., Accounting for blighting plant and disfiguring animal diseases, J. Creation 32(3):97–104, 2018.
- de Silva, P. and Bernal, X., Evolution of blood sucking insects, 2013, academia.edu/6446149/Evolution_of_blood_sucking_insects; Lehane, M.J., The Biology of Blood-Sucking in Insects, 2nd edn, Cambridge University Press, Cambridge, p. 14, 2005.
- Peterson, C.N., Day, S., Wolfe, B.E., Ellison, A.M. et al., A keystone predator controls bacterial diversity in the pitcher-plant (Sarracenia purpurea) microecosystem, Environmental Microbiology 10(9):2257–2266, 2008 | doi:10.1111/j.1462-2920.2008.01648.x.
- Spielman, ref. 8.
- Whiten, S.R., Eggleston, H., and Adelman, Z.N., Ironing out the details: exploring the role of iron and heme in blood-sucking arthropods, Frontiers in Physiology, 17 January 2018, frontiersin.org/articles/10.3389/fphys.2017.01134/full.
- Bradshaw, W.E., Burkhart, J., Colbourne, J.K. et al., Evolutionary transition from blood feeding to obligate nonbiting in a mosquito, PNAS 115(5):1009–1014, 2018.
- Wagner, P.L. and Waldor, M.K., Bacteriophage control of bacterial virulence, Infection and Immunity 70(8):3985–3993, 2002.
- Sharma, P., Das De, T., Sharma, S. et al., Deep sequencing revealed molecular signature of horizontal gene transfer of plant like transcripts in mosquito Anopheles culicifacies: an evolutionary puzzle, F1000 2015 4:1523, 2015 | doi:10.12688/f1000research.7534.1.
- Graves, M.V., Burbank, D.E., Roth, R. et al., Hyaluronan synthesis in virus PBCV-1 infected Chorella-like green algae, Virology 257(1):15–23, 1999.
- Maia, J.P., Harris, D.J., Carranza, S., and Gómez-Díaz, E., A comparison of multiple methods for estimating parasitemia of hemogregarine hemoparasites (Apicomplexa: Adeleorina) and its application for studying infection in natural populations, PLoS ONE 9(4):e95010, year | doi:10.1371/journal.pone.0095010; Sailasuta, A., Satetasit, J., and Chutmongkonkul, M., Pathological study of blood parasites in rice field frogs, Hoplobatrachus rugulosus (Wiegmann, 1834), Veterinary Medicine International 2011 | doi:10.4061/2011/850568.
- Dong, Y., Das, S., Cirimotich, C. et al., Engineered Anopheles immunity to Plasmodium infection, PLoS Pathogens 7(12):e1002458 | doi:10.1371/journal.ppat.1002458.
- Baldini, F., Segata, N., Pompon, J. et al., Evidence of natural Wolbachia infections in field populations of Anopheles gambiae, Nature Communications 5:3985, 2014 | doi:10.1038/ncomms4985; Moreira, L.A., Iturbe-Omaetxe, I., Jeffery, J.A. et al., A Wolbachia symbiont in Aedes aegypti limits infection with dengue, chikungunya, and Plasmodium, Cell 139(7):1268–1278, 2009.
- Mckeever and French, ref. 12.
- Chaston, J. and Goodrich-Blair, H., Common trends in mutualism revealed by model associations between invertebrates and bacteria, FEMS Microbiology Reviews 34(1):41–58, 2010.
- Nikoh, N. and Nakabachi, A., Aphids acquired symbiotic genes via lateral gene transfer, BMC Biology 7:12, 2009; Moran and Bennett, ref. 45.
- Doolittle, W.F., You are what you eat: a gene transfer ratchet could account for bacterial genes in eukaryotic nuclear genomes, Trends in Genetics 14(8):307–311, 1998.
- Dong, Y., Das, S., Cirimotich, C. et al., Engineered Anopheles immunity to Plasmodium infection, PLoS Pathogens 7(12):e1002458 | doi:10.1371/journal.ppat.1002458
Если вам понравилась статья, поделитесь ею со своими друзьями в соц. сетях!









 При использовании материалов служения «Апологетика Библии» прямая ссылка на веб-сайт
При использовании материалов служения «Апологетика Библии» прямая ссылка на веб-сайт